酶促反应动力学研究酶促反应速率及其影响因素。
包括:底物浓度、酶浓度、pH、温度、激活剂、抑制剂。
(一)底物浓度对反应速度的影响
米-曼氏方程:
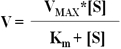
1.Km米氏常数概念:Km是酶的特征性常数之一。Km值只与酶的性质、酶所催化的底物的种类有关,与酶浓度无关。各种同工酶的Km值也不同。
2.意义
①表示酶与作用物的亲和力大小。Km越大,酶与作用物的亲和力越小。
②限速酶催化的限速反应的Km值在该连续反应中最大。
③米氏常数即为反应速度达到最大反应速度一半时的作用物浓度。米氏常数的单位为mol/L。
A型题:
关于Km值的意义,错误的是( )
A.Km是酶的特性常数
B.Km值与酶的结构有关
C.Km值与酶所催化的底物有关
D.Km值等于反应速度为最大速度一半时的酶的浓度
E.Km值等于反应速度为最大速度一半时的底物浓度
『正确答案』D
『答案解析』Km值的物理意义是:Km值等于反应速度为最大速度一半时的底物浓度。
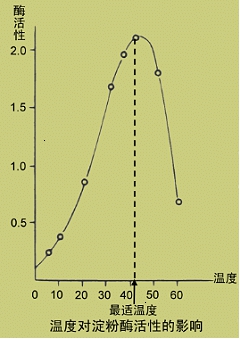
(二)温度对反应速度的影响
1.酶的最适温度:温度即不过高引起酶的变性,也不过低延缓化学反应的进行,反应进行的速度最快,此时的温度即为最适温度。
2.不是酶的特征性常数。体内多数酶的最适温度为37℃左右。
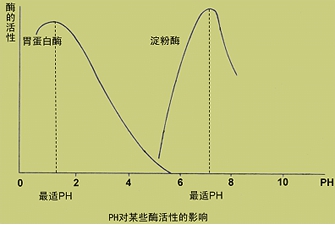
(三)pH对反应速度的影响
1.酶的最适pH:在某一pH值时,酶的各种基团处于最佳电离状态,酶的催化效率最高,此时的pH值称最适pH。
2.不是酶的特征性常数。体内多数酶的最适pH接近中性。
(四)抑制剂对反应速度的影响
抑制剂:能使酶活性下降而不引起酶蛋白变性的物质。抑制剂与酶活性中心内、外的必需基团结合而抑制酶的活性。
根据抑制剂与酶结合牢固或疏松,分为可逆性抑制与不可逆性抑制。
1.可逆性抑制
(1)定义:这类抑制剂以非共价键与酶结合,使酶活性降低或丧失。采用透析或超滤等方法可以去除,由它引起的抑制作用称可逆抑制作用。
(2)分类:竞争性抑制、非竞争性抑制、反竞争性抑制。
(3)竞争性抑制
①定义:I与S结构相似,与S竞争结合E的同一部位。
②特点:通常可以通过增大底物浓度,即提高底物的竞争能力来消除。
③酶促反应Vmax不变,Km值增大。
例,磺胺类药物的抑菌机制:与对氨基苯甲酸竞争二氢叶酸合成酶
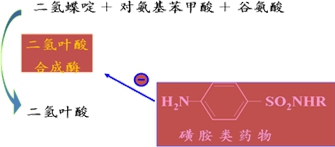
2.不可逆性抑制作用:抑制剂以共价键与酶活性中心的必需基团牢固结合,使酶失活,不能用透析超滤等简单方法消除。
(五)酶浓度对反应速度的影响
当[S]>>[E],使酶达饱和时,反应速度与酶浓度的变化近似成正比关系。
- 2020-08-262020主管药师《临床药物治疗学》章节考点:癫痫
- 2020-08-252020主管药师《临床药物治疗学》章节考点:出血性脑血管病
- 2020-08-242020主管药师《临床药物治疗学》章节考点:缺血性脑血管病
- 2020-08-232020主管药师《临床药物治疗学》章节考点:心律失常
- 2020-08-212020主管药师《临床药物治疗学》章节考点:心力衰竭
-
12020-08-262020主管药师《临床药物治疗学》章节考点:癫痫
-
22020-08-232020主管药师《临床药物治疗学》章节考点:心律失
-
32020-08-212020主管药师《临床药物治疗学》章节考点:心力衰
